Η ταύτιση των τριτοταγών δομών των ομόλογων πρωτεϊνών που είδαμε στην προηγούμενη παράγραφο είναι το βήμα που μας φέρνει στην τελική φάση της κατασκευής της δομής της άγνωστης πρωτεΐνης που μελετάμε. Σ' αυτό θα επιλέξουμε τις ομοιότητες που πιστεύουμε ότι διατηρούνται μεταξύ των διαφόρων τμημάτων των μορίων και θα τα χρησιμοποιήσουμε για τη σύνθεση της τελικής δομής.
Η τελική κατασκευή του μορίου γίνεται βασικά με ένα συνδυασμό τμημάτων των μορίων που ταυτίστηκαν. Αυτό που διατηρούμε από τα τμήματα που επιλέγουμε είναι τα τμήματα της αμινοξικής τους ακολουθίας, στη μορφή των κρυσταλλογραφικών συντεταγμένων που παρήγαγε η μέθοδος των ελαχίστων τετραγώνων. Πάνω σ' αυτά θα διατηρήσουμε τις πλευρικές αλυσίδες των κομματιών που ταυτίζονται (ως προς τα αμινοξέα) με την ακολουθία της πρωτεΐνης που θέλουμε να κατασκευάσουμε. Τα κομμάτια που δεν ταυτίζονται δημιουργούνται από το πρόγραμμα με βάση την πιο συνηθισμένη γεωμετρία τους.
Η επιλογή των τμημάτων των πρωτεϊνών γνωστής δομής γίνεται μέσα από την προβολή των ακολουθιών στο παράθυρο εργασίας του ΗοΜο. Η διαδικασία περιγράφεται στο εγχειρίδιο του προγράμματος που υπάρχει στο Παράρτημα Β όπου ο ενδιαφερόμενος μπορεί να δει και τον τρόπο με τον οποίο γίνεται η επικοινωνία των διαφόρων υποπρογραμμάτων μεταξύ. Σημαντικό πλεονέκτημα της όλης διαδικασίας είναι η δυνατότητα γρήγορης επέμβασης στα διάφορα τμήματα της διαδικασίας και τροποποίηση τους ώστε να επιτευχθεί το επιθυμητό αποτέλεσμα στο μικρότερο δυνατό χρόνο.
Η απόφαση της επιλογής των τμημάτων ανήκει ουσιαστικά στο χρήστη. Το κριτήριο που κυριαρχεί είναι η ομοιότητα των ταυτισμένων τμημάτων των γνωστών δομών με την άγνωστη δομή που μελετάμε, ως προς τη σύνθεση των αμινοξέων. Θέλει βέβαια προσοχή γιατί όπως θα δούμε και παρακάτω πολλά από αυτά τα τμήματα μπορεί να συγκρούονται μεταξύ τους. Οι συγκρούσεις μπορεί να οφείλονται σε άτομα του σκελετού της αμινοξικής ακολουθίας (που ουσιαστικά δημιουργούν και το μεγαλύτερο πρόβλημα) ή σε άτομα των πλευρικών αλυσίδων. Οι διαδικασίες που ακολουθούνται για την αποφυγή και τη διόρθωση των ανωμαλιών που προκύπτουν ποικίλουν από πρόγραμμα σε πρόγραμμα, χωρίς να υπάρχει κάποια κοινά αποδεκτή διαδικασία για την επίλυσή τους.
Με την κατασκευή των τμημάτων που επιλέξαμε έχουμε μια πρώτη πρόβλεψη (τουλάχιστον ως προς το σκελετό), του μορίου που θέλουμε να κατασκευάσουμε. Το Franky παράγει σ' αυτό το στάδιο ένα αρχείο, σε κρυσταλλογραφικές συντεταγμένες, με το σκελετό του μορίου που επιλέξαμε. Αυτό γίνεται κυρίως για να μπορεί ο χρήστης να αναγνωρίζει τα αυθεντικά τμήματα του σκελετού των μορίων όπως τα επέλεξε, όταν θα τα προβάλλει με την υπόλοιπη κατασκευή του μορίου. Τα προβλήματα που μπορεί να υπάρξουν σ' αυτό το στάδιο (λόγω συγκρούσεων ατόμων των διαφόρων τμημάτων των σκελετών) θα αντιμετωπιστούν συνολικά αργότερα όταν θα προστεθούν και οι πλευρικές αλυσίδες. Αυτό γίνεται διότι στο πρωταρχικό στάδιο που βρισκόμαστε οι επεμβάσεις μας στη δομή θα αγνοούσαν τη συμβολή των πλευρικών αλυσίδων που μπορεί να οδηγούσε σε διαφορετικές κατευθύνσεις. Σε γενικές περιπτώσεις πάντως τα προβλήματα σ' αυτό το στάδιο είναι περιορισμένα εφόσον ο βαθμός ομοιότητας των πρωτεϊνών είναι μεγάλος, δηλαδή η ομολογίαμεταξύ τους είναι ισχυρή.
Κατασκευή Αμινοξικού Σκελετού
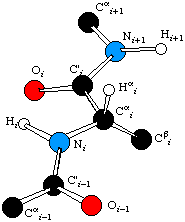
Η διαδικασία σύνθεσης της τελικής δομής ξεκινάει με την κατασκευή του σκελετού των τμημάτων που επιλέγηκαν. Αυτή είναι μια απλή λειτουργία όπου το πρόγραμμα αντιγράφει τις συντεταγμένες των ατόμων τμημάτων των κρυσταλλοδομών που επιλέγηκαν από τα αντίστοιχα αρχεία που παρήγαγε το Lsq_fit. Τα άτομα που αντιγράφονται είναι αυτά που ανήκουν μόνο στον αμινοξικό σκελετό όπως φαίνεται στην εικόνα Α.

Εικόνα Α Άτομα Αμινοξικού Σκελετού
Αυτό είναι και το πιο απλό βήμα στην ολική διαδικασία κατασκευής της τελικής δομής. Η δυσκολία αρχίζει στις περιπτώσεις που ο χρήστης θέλει να δημιουργήσει τμήματα δευτεροταγών δομών χωρίς αναφορά στις συντεταγμένες των ατόμων των αρχείων των κρυσταλλοδομών. Σ' αυτές τις περιπτώσεις θα πρέπει να επιλέξει τα τμήματα της άγνωστης δομής με το χαρακτηρισμό της δευτεροταγούς δομής που θέλει. Τα τμήματα αυτά δεν είναι δυνατό να επικαλύπτονται με τμήματα που επιλέγηκαν από τις γνωστές κρυσταλλοδομές λόγω της πειραματικής αξιοπιστίας των δεύτερων.
Στη σημερινή μορφή του προγράμματος είναι δυνατή η επιλογή μόνο δύο κανονικών δομών και συγκεκριμένα της α-έλικας και των β-κλώνων. Ο λόγος για την ύπαρξη μόνο αυτών οφείλεται στη βασική τους συνεισφορά στη σταθερότητα των μορίων και ειδικότερα στη συμμετοχή τους στη δημιουργία συμπαγών πυρήνων ή τμημάτων των μορίων. Οι υπόλοιπες δευτεροταγείς δομές είναι σχετικά πιο ασταθείς ως προς τη μορφολογία τους και πιο περιοριστικές ως προς το βαθμό ελευθερίας που θέλουμε σ' αυτό το στάδιο. Με λίγα λόγια θα περιόριζαν αισθητά τις πιθανές στερεοδιατάξεις που θα μπορούσε να έχουν κάποια τμήματα του άγνωστου μορίου που μελετάμε με αποτέλεσμα τη μεγάλη πιθανότητα σφάλματος.
Επιπλέον των κανονικών δομών έχουμε και την κατηγορία των μη κανονικών (coil ή random coil) που είναι απαραίτητες για την συμπλήρωση των τμημάτων που δεν ανήκουν σε καμία γνωστή περίπτωση. Σαν αρχική γεωμετρική μορφή τέτοιων τμημάτων ελήφθη η χαλαρή μορφή μιάς έλικας. Τα χαρακτιριστικά της είναι η ακτίνα της κυκλικής τροχιάς της, το βήμα της που αναφέρεται στο πλήθος των καταλοίπων για την ολοκλήρωση μιας περιστροφής και η μετατόπιση ανά κατάλοιπο κατά μήκος του άξονά της. Οι τιμές που υιοθετήθηκαν είναι οι πιο συνηθισμένες αυτών των κομματιών που παρατηρούνται κυρίως στις κρυσταλλογραφικές δομές.
Στην προηγούμενη κατηγορία ανάγει ουσιαστικά το πρόγραμμα και τις στροφές ή φουρκέτες. Ο λόγος για αυτή την επιλογή είναι η αβεβαιότητα που συνεπάγεται η κατασκευή τους στις περιπτώσεις που το πλήθος των καταλοίπων αυτών των τμημάτων δεν είναι αυτό που απαιτούν οι στερεοχημικοί περιορισμοί. Μια πιο αυστηρή αντιμετώπισή τους και προσαρμογή της γεωμετρίας τους αναμένεται να γίνει με τη μέθοδο των γενετικών αλγορίθμων, όπου καλύπτονται και οι περιπτώσεις παραλλαγών στη μορφολογία των διαφόρων δομών ακόμη και των τμημάτων που επιλέγηκαν από τα αρχεία των γνωστών δομών.
Η διαδικασία τοποθέτησης των τμημάτων δευτεροταγών χαρακτηριστικών και μη κανονικών δομών που επιλέξαμε ξεκινάει με τον εντοπισμό του πειραματικού τμήματος (που επιλέξαμε από τις υπάρχουσες γνωστές δομές) με το οποίο θα πρέπει να συνδεθεί το αμινικό άκρο του δευτεροταγούς τμήματος. Αν εντοπιστεί τέτοιο τμήμα το πρόγραμμα προχωράει στη συγκόλληση των δύο τμημάτων φροντίζοντας να ικανοποιείται η γεωμετρία του διπεπτιδικού δεσμού (Εικόνα Β). Φυσικά μια τέτοια κατασκευή με σχετικά τυχαίο προσανατολισμό, θα δημιουργήσει πολλές στερεοχημικές ανωμαλίες.
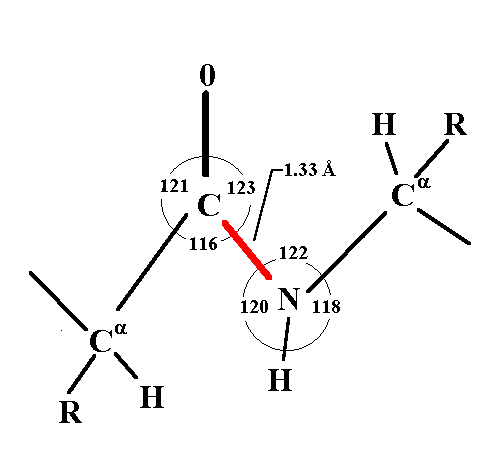
Εικόνα Β Γεωμετρικά Χαρακτηριστικά διπεπτιδικού δεσμού
Στην περίπτωση που το δευτεροταγές κομμάτι που δημιουργείται δε συνδέεται άμεσα με κάποιο πειραματικό τμήμα, η Franky προσπαθεί να εντοπίσει τουλάχιστον ένα πειραματικό τμήμα. Αν το βρει χτίζει πάνω σ’ αυτό τα υπόλοιπα δευτεροταγή τμήματα με τη διαδικασία που προαναφέραμε. Αν δεν το βρει επιχειρεί να το συνδέσει με το αμέσως γειτονικό του δευτεροταγές. Αν και τώρα δεν βρει κάποιο τμήμα, είμαστε στην περίπτωση που ο χρήστης έχει επιλέξει μόνο δευτεροταγή τμήματα. Αυτή η επιλογή ξεφεύγει τελείως από την κατηγορία πρόβλεψης (των ομόλογων πρωτεϊνών) που μελετάμε. Παρ’ όλα αυτά το πρόγραμμα θα δημιουργήσει μία κατασκευή στην αρχή του τρισορθογώνιου συστήματος αναφοράς. Το μόνο σίγουρο σ’ αυτή την περίπτωση είναι ότι η δομή αυτή δεν έχει (στο σύνολο της τουλάχιστον) καμία σχέση με την πραγματική που παρατηρούμε στη φύση. Οι λόγοι που ενσωματώσαμε αυτή τη περίπτωση είναι βασικά δύο. Πρώτον διότι μπορεί ο χρήστης να θέλει μια τέτοια αρχική κατασκευή για πειραματισμό και για είσοδο σε άλλα προγράμματα πρόβλεψης δομής και δεύτερον για τη δυνατότητα μελλοντικής επέκτασης του λογισμικού ώστε να καλυφθούν και άλλες κατηγορίες πρόβλεψης.
Προσαρμογή - Πρόσθεση Πλευρικών Αλυσίδων
Η ολοκλήρωση μιας υποθετικής δομής γίνεται με την τοποθέτηση των πλευρικών αλυσίδων πάνω στο σκελετό της αμινοξικής ακολουθίας. Η διαδικασία τοποθέτησης περιλαμβάνει την αναγνώριση της ταυτότητας του κάθε αμινοξέος και την κατασκευή του με βάση τη χημική του σύνθεση και με βάση το αμινοξύ της πειραματικής δομής το οποίο αντικαθιστά. Στην περίπτωση που δεν υπάρχει πειραματική δομή αλλά δευτεροταγές κομμάτι τότε το αμινοξύ θα τοποθετηθεί στην πιο πιθανή του στερεοδιάταξη.
Η χημική σύνθεση των αμινοξέων (δηλαδή το είδος των ατόμων που το αποτελούν) λαμβάνεται με βάση τον IUPAC χαρακτηρισμό τους και οι θέσεις των ατόμων που το συνθέτουν βγαίνουν από κρυσταλλογραφικά δεδομένα. Στην εικόνα Γ βλέπουμε ενδεικτικά τον IUPAC χαρακτηρισμό των ατόμων της Αργινίνης και της Τριπτοφάνης. Με βάση αυτόν το χαρακτηρισμό το Franky συνθέτει τη δομή της κάθε πλευρικής αλυσίδας. Πιο συγκεκριμένα, για τα τμήματα που απορρέουν μέσα από επιλογές πειραματικών τμημάτων ομόλογων πρωτεϊνών η διαδικασία κατασκευής ακολουθεί την εξής διαδρομή.
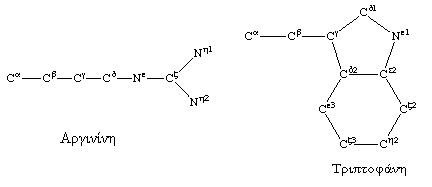
Εικόνα Γ Ονομασία
IUPAC
των Ατόμων Αργινίνης και Τριπτοφάνης
Για κάθε αμινοξύ Ri της άγνωστης δομής που αντικαθιστά το αμινοξύ Rj μιας κρυσταλλογραφικά λυμένης δομής το πρόγραμμα ελέγχει το είδος των ατόμων τα οποία ταυτίζονται με βάση την IUPAC ονομασία τους. Από τις πειραματικές δομές το πρόγραμμα διατηρεί τα άτομα με τον κοινό χαρακτηρισμό για όσα από αυτά υπάρχουν. Για τα άτομα του Riπου δεν υπάρχει αντίστοιχο στο Rj το πρόγραμμα αρχίζει την κατασκευή τους με βάση τις πιο πιθανές τιμές των γωνιών στροφής τους. Στην εικόνα Δ βλέπουμε διάφορους συνδυασμούς μετατροπών αμινοξέων. Στα αριστερά σχήματα φαίνονται πιθανά αμινοξέα Rj γνωστών δομών ενώ στη μέση έχουμε το τμήμα που προσθέτει το πρόγραμμα. Στο δεξιό τμήμα των εικόνων βλέπουμε τα αμινοξέα της άγνωστης δομής όπως κατασκευάζονται.
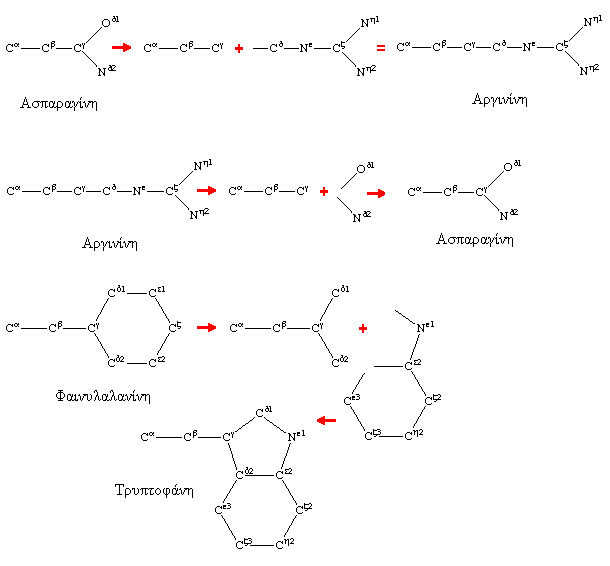
Εικόνα Δ Κατασκευή Πλευρικών Αλυσίδων
Με τη διαδικασία κατασκευής των αμινοξέων
της άγνωστης δομής πάνω στο σκελετό των αμινοξέων των γνωστών κομματιών
είναι φυσιολογικό να προκύψουν ατέλειες λόγω των διαφορετικών γεωμετρικών
περιορισμών των ατόμων που συνδέονται από διαφορετικούς δεσμούς. Το πρόβλημα
αυτό δεν είναι ουσιαστικά έντονο και στην πρώτη φάση της κατασκευής του
μορίου μπορεί να αγνοηθεί. Αν όμως ο χρήστης επιμένει στην εξάλειψη των
πιθανών ανωμαλιών που θα προκύψουν, τότε θα πρέπει να κάνει χρήση κάποιου
προγράμματος ελαχιστοποίησης της ενέργειας, όπου και θα έχουμε τη διόρθωση
αυτών των ανωμαλιών από τα πρώτα βήματα εκτέλεσης. Το πρόγραμμα αποθηκεύει
τη δομή που δημιούργησε στη μορφή των αρχείων της PDB
για κάθε χρήση που θα σκεφθεί ο ενδιαφερόμενος χρήστης.